Highlight
Metall-Ionen beeinflussen Enzymaktivität durch Veränderung der Membranspannung
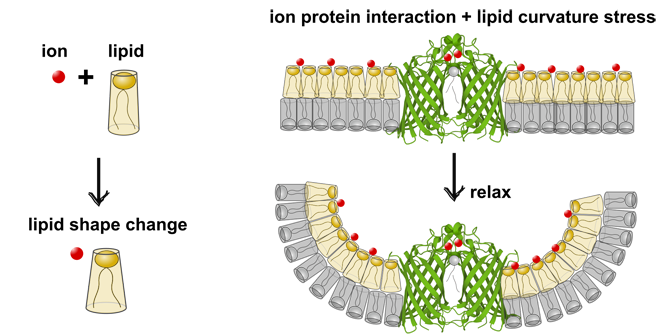
Metall-Ionen sind wichtige Helfer für Proteine. Oft sorgen sie dafür, dass Proteine richtig funktionieren und stabil bleiben. Beim Enzym OmpLA (ein Enzym in der äußeren Zellmembran von Gram-negativen Bakterien) helfen Calcium-Ionen, damit es in seiner aktiven Form bleibt.
Wir haben untersucht, wie OmpLA Lipide in der Membran abbaut (hydrolysiert). Dabei haben wir verschiedene Membranen getestet: elektrisch neutral und negativ geladen sowie mit symmetrischer oder asymmetrischer Lipidverteilung.
In Membranen ohne Ladung war OmpLA in symmetrischen Membranen aktiver als in asymmetrischen Membranen. Das liegt daran, dass es keine Spannungsunterschiede zwischen den beiden Membranschichten gibt. Überraschenderweise war es bei geladenen Membranen genau umgekehrt: Hier war OmpLA in asymmetrischen Membranen aktiver.
Röntgenkleinwinkel-Messungen zeigten, dass sich die Form der geladenen Lipide verändert, sobald Calcium hinzugefügt wird. Dadurch wird die Spannung in asymmetrischen Membranen verringert, was die Enzymaktivität erhöht. Ein ähnlicher Effekt trittt auch mit Natrium-Ionen auf. Diese beeinflussen die Lipidform, aber sie binden nicht direkt an das Protein.
Unsere Ergebnisse zeigen, dass Metall-Ionen nicht nur direkt mit Membranproteinen reagieren. Sie beeinflussen deren Aktivität auch indirekt, indem sie die Form der Lipide verändern.
- Link zum Artikel: P. Piller et al., RSC App Interf 2: 69 – 73 (2025) DOI: 10.1039/D4LF00309H.
Aus: Piller et al., RSC Appl. Interf (2025), Lizenz: (CC-BY 4.0 DEED)
Übersicht wichtiger Beiträge
- P. Piller, P. Reiterer, E.F. Semeraro, & G. Pabst, Metal ion cofactors modulate integral enzyme activity by varying differential membrane curvature stress, RSC App Interf 2: 69 – 73 (2025) DOI: 10.1039/D4LF00309H.
- M.P.K Frewein, P. Piller, E.F. Semeraro, O. Czakkel, Y. Gerelli, L. Porcar & G. Pabst, Distributing aminophospholipids asymmetrically across leaflets causes anomalous membrane stiffening, Biophys. J. 122, 2445 (2023), DOI: 10.1016/j.bpj.2023.04.025.
- P. Piller, E.F. Semeraro, G. N. Rechberger, S. Keller & G. Pabst, Allosteric modulation of integral protein activity by differential stress in asymmetric membranes, PNAS Nexus 2, 1 (2023), DOI: 10.1103/10.1093/pnasnexus/pgad126.
- J. Jennings, & G. Pabst, Multiple routes to bicontinuous cubic liquid crystal phases discovered by high-throughput self-assembly screening of multi-tail lipidoids, Small 2206747 (2023), DOI: 10.1002/smll.202206747.
- E.F. Semeraro, L. Marx, J. Mandl, I. Letofsky-Papst, C. Mayrhofer, M.P.K. Frewein, H.L. Scott, S. Prévost, H. Bergler, K. Lohner & G. Pabst, Lactoferricins impair the cytosolic membrane of Escherichia coli within a few seconds and accumulate inside the cell, eLife 11, e72850 (2022), DOI: 10.1101/2021.09.24.461681.
- M.P.K. Frewein, P. Piller, E.F. Semeraro, K.C. Batchu, F.A. Heberle, H.L. Scott, Y. Gerelli, L. Porcar, and G. Pabst, Interdigitation-induced order and disorder in asymmetric membranes, J Membrane Biol. (2022), DOI: 10.1007/s00232-022-00234-0.
- M. Kaltenegger, J. Kremser, M.P. Frewein, P. Ziherl, D.J. Bonthuis & G. Pabst, Intrinsic lipid curvatures of mammalian plasma membrane outer leaflet lipids and ceramides, Biochim. Biophys. Acta 1836, 183709 (2021), DOI: 10.1016/j.bbamem.2021.183709.
- B. Eicher, D. Marquardt, F.A. Heberle, I. Letofsky-Pabst, G.N. Rechberger, M.-S. Appavou, J. Katsaras & G. Pabst, Intrinsic curvature-mediated transbilayer coupling in asymmetric lipid vesicles, Biophys. J. 114, 146 (2018), DOI: 10.1016/j.bpj.2017.11.009.
- B.-S. Lu, S.P. Gupta, M. Belička, R. Podgornik & G. Pabst, Modulation of elasticity and interactions in charged lipid multibilayers: monovalent salt solutions, Langmuir 32, 1355 (2016), DOI: 10.1021/acs.langmuir.6b03614.
- B. Kollmitzer, P. Heftberger, R. Podgornik, J.F. Nagle & G. Pabst, Bending rigidities and interdomain forces in membranes with coexisting lipid domains Biophys. J. 108, 2833 (2015), DOI: 10.1016/j.bpj.2015.05.003.
- E.F. Semeraro, M.P.K. Frewein, & G. Pabst, Chapter Fourteen - Structure of symmetric and asymmetric lipid membranes from joint SAXS/SANS, in Methods in Enzymol, T. Baumgart, M. Deserno (edts), Academic Press, 700: 349 - 383 (2024) DOI: 10.1016/bs.mie.2024.02.017.
- G. Pabst, & S. Keller, Exploring membrane asymmetry and its effects on membrane proteins, Trends Biochem Sci, 49: 333 -345 (2024) DOI: 10.1016/j.tibs.2024.01.007
- G.J. Schütz & G. Pabst, The asymmetric plasma membrane—A composite material combining different functionalities? BioEssays 45: 2300116 (2023) DOI: 10.1002/bies.202300116
- E.F. Semeraro, L. Marx, M.P.K. Frewein, and G. Pabst. Increasing complexity in small-angle X-ray and neutron scattering experiments: from biological membrane mimics to live cells, Soft Matter 17: 222 - 232 (2021) DOI: 10.1039/C9SM02352F
- D. Marquardt, F.A. Heberle, J.D. Nickels, G. Pabst, & J. Katsaras. On scattered waves and lipid domains: detecting membrane rafts with X-rays and neutrons. Soft Matter 11: 9055 - 9072 (2015). DOI: 10.1039/C5SM01807B
- D. Marquardt, B. Geier, and G. Pabst, Asymmetric lipid membranes: towards more realistic model systems. Membranes 5: 180 - 196 (2015). DOI: 10.3390/membranes5020180
G. Pabst, N. Kučerka, M.-P. Nieh, & J Katsaras (Hg), Liposomes, Lipid Bilayers and Model Membranes From Basic Research to Application, CRC Press (2014) ISBN: 9781138198753